2025新鲁教版九年级化学上册(五四学制)电子课本(最高清下载打印)
2025年学生将迎来新版教材,新教材将更加重视思维和阅读!为了方便广大学生在暑假预习新学期的课本知识,我们整理了2025新
鲁教版九年级化学上册(五四学制)一电子课本,以图片的形式呈现给大家,希望对同学们的暑期学习有所帮助。
如需全套电子课本PDF版,请关注公众号“桃李科普”回复:“电子课本”
鲁教版九年级化学上册(五四学制)电子课本在线阅读











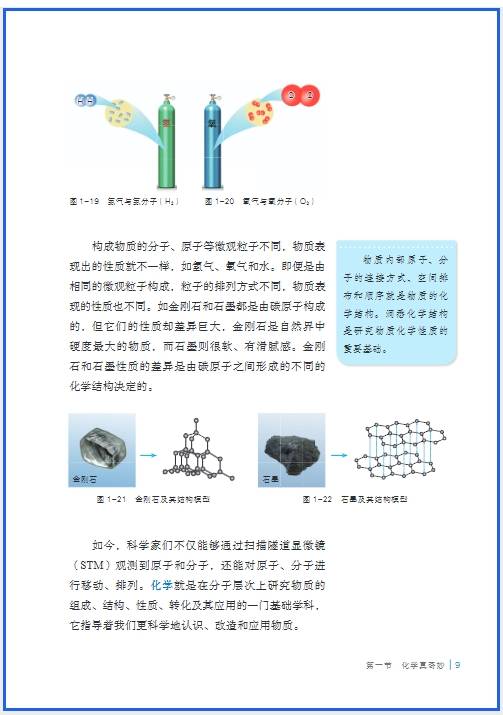


九年级化学是对初中化学知识的深化与拓展,核心围绕 “物质的性质与转化”“化学计算与实验探究” 展开,同时衔接高中化学基础概念。以下是分模块梳理的核心知识点,结合考试重点与应用场景详细说明:
一、物质的构成与化学用语(贯穿全册的基础)
这部分是化学的 “语言系统”,是后续学习的前提,需精准掌握。
1. 原子、分子、离子的深化
- 原子结构:
- 明确原子由原子核(质子 + 中子) 和核外电子构成,其中:
- 质子数 = 核电荷数 = 原子序数(决定元素种类);
- 相对原子质量 ≈ 质子数 + 中子数(中子数决定元素的同位素,如碳 - 12、碳 - 14)。
- 核外电子排布:理解 “分层排布” 规律(第一层最多 2 个,第二层最多 8 个,最外层最多 8 个,遵循 “能量最低原理”),能通过原子结构示意图判断元素类别(如最外层电子数<4 为金属元素,≥4 为非金属元素,=8 为稀有气体元素,氦为 2)。
- 分子与离子:
- 分子:保持物质化学性质的最小粒子(如氧气分子保持氧气的助燃性,冰和水都是水分子构成,化学性质相同),能用分子观点解释 “热胀冷缩”(分子间隔变化)、“闻到气味”(分子不断运动)。
- 离子:原子得失电子形成的带电粒子(如钠原子失 1 个电子成 Na⁺,氯原子得 1 个电子成 Cl⁻),理解 “离子化合物”(如 NaCl,由离子构成)和 “共价化合物”(如 H₂O,由分子构成)的区别。
2. 化学用语(核心考点,高频出错)
- 元素符号与化合价:
- 牢记前 20 号元素及铁(Fe)、铜(Cu)、锌(Zn)、银(Ag)、钡(Ba)、锰(Mn)、汞(Hg)等常见金属符号,注意书写规范(首字母大写,次字母小写,如 “Co” 是钴,“CO” 是一氧化碳,勿混淆)。
- 化合价规则:
- 常见元素化合价:H 为 + 1,O 为 - 2,金属元素多为正价(如 Na⁺为 + 1,Al³⁺为 + 3),非金属元素多为负价(如 Cl⁻为 - 1,S²⁻为 - 2);
- “化合物中正负化合价代数和为 0”(用于推导未知元素化合价,如 KMnO₄中 Mn 的化合价:1 + x + 4×(-2)=0 → x=+7);
- 常见原子团化合价:OH⁻(-1)、CO₃²⁻(-2)、SO₄²⁻(-2)、NO₃⁻(-1)、NH₄⁺(+1)。
- 化学式与化学方程式:
- 化学式:用元素符号表示物质组成的式子,能根据化合价写化学式(正价在前,负价在后,交叉定个数,如氧化铝:Al 为 + 3,O 为 - 2 → Al₂O₃),理解化学式的意义(如 H₂O:表示水、1 个水分子、水由 H 和 O 组成、1 个水分子由 2 个 H 和 1 个 O 构成)。
- 化学方程式:
- 书写原则:以客观事实为依据(不能凭空造物质)、遵循质量守恒定律(反应前后原子种类、数目、质量不变);
- 书写步骤:写反应物和生成物(“→” 连接,条件标在上方,气体 “↑”、沉淀 “↓” 标在生成物右侧,注意反应物有气体 / 固体时,生成物不标)→ 配平(最小公倍数法、观察法等,如 2H₂O₂ \(\stackrel{MnO_2}{=\!=\!=}\) 2H₂O + O₂↑)→ 检查;
- 意义:表示 “反应物、生成物、反应条件”(质的意义)、“各物质微粒个数比”(量的意义,如 2H₂ + O₂ \(\stackrel{点燃}{=\!=\!=}\) 2H₂O 中,H₂、O₂、H₂O 的分子个数比为 2:1:2)、“各物质质量比”(如上述反应中质量比为 4:32:36=1:8:9)。
二、物质的分类与常见物质性质(重点应用模块)
九年级会细化物质分类标准,并深入学习酸、碱、盐、金属等核心物质的性质与转化。
1. 物质的分类(逻辑体系,需精准区分)
分类层级定义与判断依据举例混合物由两种或多种物质混合而成(无固定组成,各成分保持原有性质)空气、溶液(如食盐水)、合金(如生铁)纯净物由一种物质组成(有固定组成,可用化学式表示)O₂、H₂O、NaCl├─ 单质由同种元素组成的纯净物(分为金属单质、非金属单质、稀有气体)Fe(金属)、O₂(非金属)、He(稀有气体)└─ 化合物由不同种元素组成的纯净物H₂O、CO₂、NaOH├─ 氧化物由两种元素组成,且其中一种是氧元素的化合物CO₂、CuO、H₂O(注意:KMnO₄不是氧化物,因含 3 种元素)├─ 酸解离时产生的阳离子全部是 H⁺的化合物(命名多为 “某酸”)HCl(盐酸)、H₂SO₄(硫酸)、HNO₃(硝酸)├─ 碱解离时产生的阴离子全部是 OH⁻的化合物(命名多为 “氢氧化某”)NaOH(氢氧化钠)、Ca (OH)₂(氢氧化钙)└─ 盐由金属离子(或 NH₄⁺)和酸根离子构成的化合物(命名多为 “某化某”“某酸某”)NaCl(氯化钠)、Na₂CO₃(碳酸钠)、NH₄Cl(氯化铵)
2. 常见物质的性质与用途(高频考点,结合实验)
